Поняття про амфотерність
Ви вже вивчили сполуки, що виявляють кислотні або основні властивості. Деякі сполуки можуть виявляти і кислотні, і основні властивості. Кислотні властивості виявляють переважно сполуки неметалічних елементів, а основні — металічних елементів. Якщо елемент перебуває на межі між металічними та неметалічними елементами, то цілком очікувано, що його сполуки мають виявляти властивості, характерні як для кислотних, так і для основних речовин. Такі сполуки називають амфотерними.
Речовини, що можуть виявляти кислотні й основні властивості залежно від сполуки, з якою вони взаємодіють, називають амфотерними.
Амфотерні властивості можуть виявляти оксиди й гідроксиди деяких хімічних елементів у ступенях окиснення +2, +3 та +4. Серед них Верилій(+2), Цинк(+2), Станум(+2), Плюмбум(+2), Алюмі-ній(+3), Ферум(+3), Хром(+3), Титан(+4).
Амфотерні гідроксиди
При взаємодії з кислотами амфотерні гідроксиди поводяться як звичайні нерозчинні основи. Тобто продуктами реакції амфотерного гідроксиду з кислотою є сіль і вода;
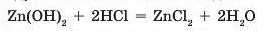
При взаємодії з іншими основами амфотерні гідроксиди виявляють кислотні властивості. Тобто з основами амфотерні гідроксиди реагують, як кислоти: вступають у реакцію з утворенням солі. Але склад солі залежить від умов, за яких відбувається взаємодія: у розчині чи при сплавлянні.
• У розчинах амфотерні гідроксиди взаємодіють тільки з лугами з утворенням складних (комплексних) солей.
Наприклад, цинк гідроксид з натрій гідроксидом реагує за рівнянням:
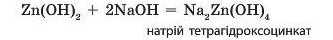
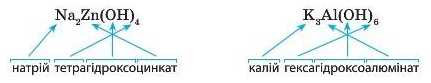
Як для звичайних солей, назва комплексної солі складається з двох слів. Але слід указати число груп OH у складі солі: префікс тетра означає, що гідроксильних груп чотири, а префіксом гекси позначається шість груп ОН, наприклад:
Подібно до цинк гідроксиду реагує з лугами й алюміній гідроксид. Але залежно від концентрації лугу з алюміній гідроксиду може утворитися тетрагідроксоалюмінат (з розбавленим розчином лугу) або гексагідроксоалюмінат (з концентрованим розчином):
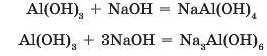
• При сплавлянні амфотерні гідроксиди можуть взаємодіяти не тільки з лугами, а й з нерозчинними гідроксидами. При цьому утворюються також солі, але із більш звичним складом:
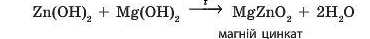
Як і в розчинах, з алюміній гідроксиду може утворитися дві різні солі залежно від кількості доданого лугу:
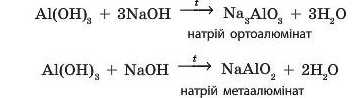
При сплавлянні амфотерні гідроксиди можуть взаємодіяти також і з основними оксидами:
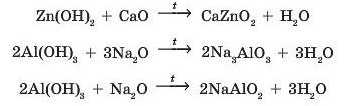
Для того щоб правильно записати рівняння реакції за участю амфотерних гідроксидів при сплавлянні, амфотерні гідроксиди необхідно розглядати як кислоти. Так, формулу цинк гідроксиду Zn(OH)2 можна записати як формулу кислоти H2ZnO,. Ця кислота буде мати назву цинкатна, вона має кислотний залишок ZnO2 із зарядом -2, її солі — цинкати. Так само формулу алюміній гідроксиду можна записати H3AIO3: кислотний залишок AIOj із зарядом -З, солі — ортоалюмінати. Якщо з алюміній гідроксиду прибрати одну молекулу води, то формула кислоти буде HAIO2: кислотний залишок AIO2 із зарядом -1, а солі — метаалюмінати.
Амфотерні ОКСИДИ
З кислотами амфотерні оксиди взаємодіють, як звичайні основні оксиди: між ними відбуваються реакції обміну, у яких утворюються сіль та вода:

При взаємодії з основними речовинами вони вступають у реакції, як кислотні оксиди. Тобто взаємодіють з основними оксидами й основами з утворенням солей. Але амфотерні оксиди взаємодіють з основами й основними оксидами тільки при сплавлянні (без участі води) і утворюють такі самі солі, як і амфотерні гідроксиди.
При сплавлянні цинк оксиду з натрій гідроксидом або натрій оксидом утворюється натрій цинкат, тільки в першому' випадку утворюється ще й вода:
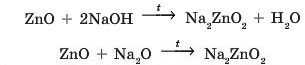
і і і
Амфотерні оксиди та їхні сполуки досить поширені в природі. Алюмінати є складовими частинами багатьох ґруштів та глини.
Деякі хімічні елементи виявляють змінну валентність, причому властивості сполук з різними валентностями можуть істотно відрізнятися. Так, ферум(ІІ) оксид FeO — це основний оксид, а ферум(ІІІ) оксид Fe2O3 — амфотерний. Отже вони можуть взаємодіяти один з одним при сплавлянні, причому утворений продукт також складається з атомів Феруму й Оксигену — ^ejO4- Uto сполуку називають змішаним оксидом (або залізною окалиною), хоча вона є сіллю, що складається з металічного елемента Феруму(ІІ) та кислотного залишку фератної кислоти Fe(FeO2)2.
Висновки
1. Амфотерність — здатність хімічних сполук виявляти як кислотні, так і основні властивості залежно від природи доданого реагенту. До амфотерних належать оксиди й гідроксиди деяких елементів: Бе-рилію(+2), Цинку(+2), Стануму(+2), Плюмбуму(+2), Алюмінію(+3), Феру-му(+3), Хрому(+3), Титану(+4).
2. Амфотерні гідроксиди в розчинах взаємодіють тільки з лугами з утворенням солей, що містять гідроксильні групи. При сплавлянні вони можуть також взаємодіяти з основними оксидами та гідроксидами. Амфотерні оксиди взаємодіють з основними речовинами тільки при сплавлянні.
Контрольні запитання
1. Що означає вираз: «сполука виявляє амфотерні властивості»?
2. Які сполуки є амфотерними? Наведіть приклади.
3. Які хімічні елементи та в яких валентностях утворюють амфотерні речовини?
Завдання для засвоєння матеріалу
1. Складіть рівняння реакції взаємодії цинк гідроксиду з калій гідроксидом у розчині та при сплавлянні. Назвіть продукти реакції.
2. Складіть рівняння реакції взаємодії алюміній гідроксиду:
а) з хлоридною кислотою;
б) барій гідроксидом при сплавлянні;
в) барій оксидом.
3. Складіть рівняння реакцій утворення калій алюмінату KjAIOj взаємодією:
а) амфотерного гідроксиду з лугом;
б) амфотерного оксиду з лугом;
в) амфотерного гідроксиду з основним оксидом;
г) двох оксидів.
4. Кальцій оксид і алюміній оксид за зовнішнім виглядом майже однакові. Як їх можна розрізнити, використовуючи хімічні реакції?
5. Які з наведених речовин: КОН, FeCIj, HjSO4 можуть взаємодіяти: а) з натрій гідроксидом; 6) купрум(ІІ) гідроксидом; в) цинк гідроксидом? Складіть відповідні рівняння реакцій.
6. З якими з наведених речовин взаємодіє натрій гідроксид: KjO, MgCOj, H3PO4, HjS, FeCIj, Fe(OH)jf AICIj, Zn(OH)jf КСІ, SOj? Складіть рівняння реакцій та назвіть продукти реакцій.
7. Складіть рівняння реакцій, що відповідають таким перетворенням:
а) Al -» AIjOj -» AICIj -> AI(OH)j -» NajAIOj;
б) ZnSO4 -» Zn(OH)j -» ZnO -» KjZnOj -> ZnCIj -» Zn(OH)j -> KjZn(OH)4.
8. Обчисліть масу барій гідроксиду, що необхідний для добування барій цинкату масою 11,7 г із цинк оксиду.
9. До розчину цинк сульфату масою 483 г із масовою часткою солі 5 % додали розчин натрій гідроксиду до повного розчинення осаду. Обчисліть масу сполуки Цинку.
10*. У додаткових джерелах знайдіть інформацію про використання сполук Алюмінію для очищення води. На яких властивостях цих сполук ґрунтується цей спосіб?
Немає коментарів:
Дописати коментар